Nguyên tắc sắp xếp các nguyên tố trong bảng tuần hoàn được chúng tôi sưu tầm và tổng hợp lí thuyết trong chương trình giảng dạy môn Hóa học lớp 9. Hi vọng rằng đây sẽ là những tài liệu hữu ích trong công tác giảng dạy và học tập của quý thầy cô và các bạn học sinh.
Lưu ý: Nếu bạn muốn Tải bài viết này về máy tính hoặc điện thoại, vui lòng kéo xuống cuối bài viết.
Câu hỏi: Nguyên tắc sắp xếp trong bảng tuần hoàn các nguyên tố hóa học
- Bảng hệ thống tuần hoàn hóa học hiện đã hoàn thiện với 118 nguyên tố với một dãy đầy đủ các thông tin. Các nguyên tố sẽ được sắp xếp từ trái qua phải, từ trên xuống dưới theo quy luật thứ tự tăng dần số hiệu nguyên tử. Đây là nguyên tắc sắp xếp trong bảng tuần hoàn các nguyên tố hóa học.
- Các nguyên tố trong bảng tuần hoàn hóa học sẽ được xếp theo chiều tăng dần của điện tích hạt nhân.
- Các nguyên tố giống nhau về lớp vỏ electron được đưa vào một hàng.
- Các nguyên tố có cùng hóa trị thì đưa vào một nhóm.
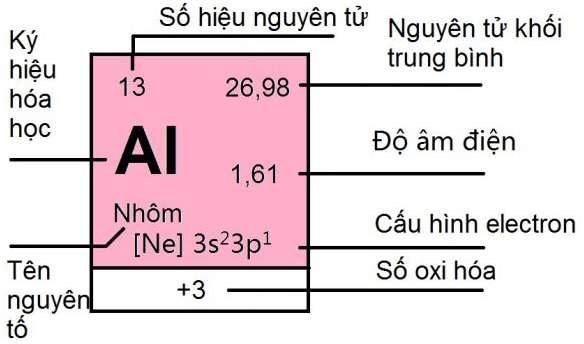
Ô nguyên tố
Bảng tuần hoàn nguyên tố hóa học gồm 118 nguyên tố, mỗi nguyên tố được xếp vào một ô nên gọi là ô nguyên tố.
Cấu tạo của ô nguyên tố
Số thứ tự của ô nguyên tố chính là số hiệu nguyên tử của nguyên tố đó. Vậy ô nguyên tố trong bảng tuần hoàn các nguyên tố hóa học cho biết điều gì? Đó là số hiệu nguyên tử( = số p = số e), kí hiệu hóa học, tên nguyên tố, nguyên tử khối, số oxi hóa,…
Chu kì
a) Định nghĩa
- Chu kì là dãy các nguyên tố mà nguyên tử của chúng có cùng số lớp electron, được sắp xếp theo chiều điện tích hạt nhân tăng dần.
b) Giới thiệu các chu kì
- Chu kì 1: gồm 2 nguyên tố H(Z=1) đến He(Z=2).
- Chu kì 2: gồm 8 nguyên tố Li(Z=3) đến Ne(Z=10).
- Chu kì 3: gồm 8 nguyên tố Na(Z=11) đến Ar(Z=18).
- Chu kì 4: gồm 18 nguyên tố K(Z=19) đến Kr(Z=36).
- Chu kì 5: gồm 18 nguyên tố Rb(Z=37) đến Xe(Z=54).
- Chu kì 6: gồm 32 nguyên tố Cs(Z=55)đến Rn(Z=86).
- Chu kì 7: Bắt đầu từ nguyên tố Fr(Z=87)đến nguyên tố có Z=110, đây là một chu kì chưa hoàn thành.
c) Phân loại chu kì
- Chu kì 1,2,3 là các chu kì nhỏ.
- Chu kì 4,5,6,7 là các chu kì lớn.
⇒Nhận xét:
- Các nguyên tố trong cùng chu kì có số lớp electron bằng nhau và bằng số thứ tự của chu kì.
- Mở đầu chu kì là kim loại kiềm, gần cuối chu kì là halogen (trừ chu kì 1); cuối chu kì là khí hiếm.
- 2 hàng cuối bảng là 2 họ nguyên tố có cấu hình electron đặc biệt: Lantan và Actini.
+ Họ Lantan: gồm 14 nguyên tố đứng sau La(Z=57) thuộc chu kì 6.
+ Họ Actini: gồm 14 nguyên tố sau Ac(Z=89) thuộc chu kì 7.
Nhóm nguyên tố
a) Định nghĩa
- Nhóm nguyên tố là tập hợp các nguyên tố mà nguyên tử có cấu hình electron tương tự nhau, do đó có tính chất hóa học gần giống nhau và được sắp xếp thành một cột.
b) Phân loại
- Bảng tuần hoàn chia thành 8 nhóm A (đánh số từ IA đến VIIIA) và 8 nhóm B (đánh số từ IB đến VIIIB). Mỗi nhóm là một cột, riêng nhóm VIIIB gồm 3 cột.
- Nguyên tử các nguyên tố trong cùng một nhóm có số electron hóa trị bằng nhau và bằng số thứ tự của nhóm (trừ hai cột cuối của nhóm VIIIB).
* Nhóm A:
- Nhóm A gồm 8 nhóm từ IA đến VIIIA.
- Các nguyên tố nhóm A gồm nguyên tố s và nguyên tố p:
+ Nguyên tố s: Nhóm IA (nhóm kim loại kiềm, trừ H) và nhóm IIA (kim loại kiềm thổ).
+ Nguyên tố p: Nhóm IIIA đến VIIIA (trừ He).
- STT nhóm = Số e lớp ngoài cùng = Số e hóa trị
+ Cấu hình electron hóa trị tổng quát của nhóm A:
⟶ nsanpb
⟶ ĐK:1≤a≤2;0≤b≤6
+ Số thứ tự của nhóm A=a+bA=a+b
⟶ Nếu a+b≤3 ⇒ Kim loại
⟶ Nếu 5≤a+b≤7 ⇒ Phi kim
⟶ Nếu a+b=8a+b=8 ⇒ Khí hiếm
+ Ví dụ:
⟶ Na(Z=11):1s22s22p63s1⇒IA
⟶ O(Z=8):1s22s22p4⇒VIA
* Nhóm B:
- Nhóm B gồm 8 nhóm được đánh số từ IIIB đến VIIIB, rồi IB và IIB theo chiều từ trái sang phải trong bảng tuần hoàn.
- Nhóm B chỉ gồm các nguyên tố của các chu kỳ lớn.
- Nhóm B gồm các nguyên tố dd và nguyên tố ff (thuộc 2 hàng cuối bảng).
- STT nhóm = Số e lớp ngoài cùng = Số e hóa trị (Ngoại lệ: Số e hóa trị = 9, 10 thuộc nhóm VIIIB)
+ Cấu hình electron hóa trị của nguyên tố dd:
⟶ (n−1)dansb
⟶ ĐK: b=2;1≤a≤10
⟶ Nếu a+b<8 ⇒ STT nhóm =a+b
⟶ Nếu a+b=8,9,10 ⇒ STT nhóm =8
⟶ Nếu a+b>10 ⇒ STT nhóm =(a+b)−10
Sự biến đổi tính chất của nguyên tố trong bảng hệ thống tuần hoàn các nguyên tố hóa học
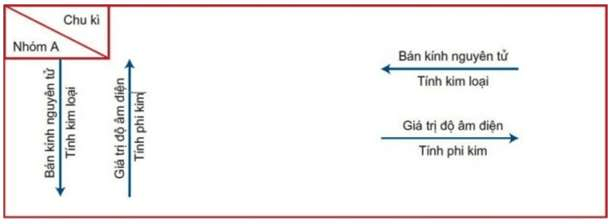
Sự biến đổi tính chất của nguyên tố trong hệ thống bảng tuần hoàn các nguyên tố hóa học
Trong một chu kì
Trong một chu kì theo chiều tăng dần của điện tích hạt nhân, tức là từ đầu đến cuối chu kì
Số electron ngoài cùng của nguyên tử các nguyên tố tăng dần từ 1 đến 8( trừ chu kì 1).
Tính kim loại của các nguyên tố yếu dần, thay vào đó tính phi kim sẽ mạnh dần.
Trong cùng một nhóm
Khi đi theo chiều tăng dần của điện tích hạt nhân từ trên xuống dưới
Số lớp electron của nguyên tử tăng dần
Các nguyên tố sẽ có tính kim loại tăng dần, tính phi kim yếu dần
Ý nghĩa của bảng tuần hoàn các nguyên tố hóa học
Quan hệ giữa vị trí và cấu tạo nguyên tử: Khi biết được vị trí của nguyên tố trong bảng tuần hoàn hóa học, ta có thể suy ra cấu tạo nguyên tử của nguyên tố đó và ngược lại.
Quan hệ giữa vị trí và tính chất của nguyên tố: Khi biết được vị trí của nguyên tố trong bảng hệ thống tuần hoàn các nguyên tố hóa học, ta có thể suy ra những tính chất hóa học cơ bản của nguyên tố đó.
So sánh tính chất hóa học của một nguyên tố với các nguyên tố lân cận nó: Dựa vào quy luật biến đổi tính chất trong một chu kì hay một nhóm nguyên tố có thể so sánh tính chất hóa học của nguyên tố đó với các nguyên tố lân cận.
Bảng tuần hoàn các nguyên tố hóa học được xem là cơ bản để có thể phát triển lên các kiến thức chuyên sâu hơn. Thông qua việc chia sẻ cấu tạo, các nguyên tắc cũng như quy luật của bảng tuần hoàn hóa học trên đây đã giúp bạn thêm phần nào nắm rõ và vận dụng tốt hơn vào bài tập.
-
Ngoài Nguyên tắc sắp xếp các nguyên tố trong bảng tuần hoàn đã được VnDoc giới thiệu, mời các bạn cùng tham khảo thêm Chuyên đề Hóa học lớp 9, Trắc nghiệm Hóa học 9, Lý thuyết môn Hóa học lớp 9 để hoàn thành tốt chương trình học THCS.


