Bài tập hóa 8 Chương 3: Mol và tính toán hóa học được VnDoc biên soạn tổng hợp các dạng bài tập hóa 8 chương 3 kèm theo đáp án hướng dẫn giải chi tiết. Tài liệu giúp các bạn nâng cao kỹ năng giải Hóa 8 từ đó học tốt môn Hóa hơn. Sau đây mời các bạn tham khảo chi tiết.
>> Mời các bạn tham khảo thêm một nội dung liên quan đến chương trình mới.
I. Câu hỏi bài tập Hóa 8 chương 3
Câu 1. Hãy cho biết số phân tử, nguyên tử có mặt trong:
a) 0,6 mol nguyên tử S
b) 2 mol phân tử FeO
c) 1,1 mol phân tử Cl2
Câu 2. Hãy cho biết khối lượng của các chất sau:
a) 1 mol nguyên tử Na
b) 0,5 phân tử NaCl
c) 0,05 mol phân tử đường glucozơ C6H12O6
Câu 3. Hãy cho biết thể tích ở điều kiện tiêu chuẩn của các hỗn hợp chất sau:
a) 0,15 mol CO và 0,5 mol H2O
b) 0,3 mol SO2 và 0,2 mol N2
c) 0,01 mol NO và 1,2 mol N2O5
Câu 4. Hãy cho biết khối lượng của N phân tử những chất sau:
H2O, HCl, NaCl, KOH
Câu 5. Tính số mol nguyên tử hoặc phân tử trong các lượng chất sau:
a) 1,44.1023 phân tử HCl
b) 24.1023 nguyên tử Na
Câu 6. Tính khối lượng của những lượng chất sau:
a) 0,3 mol nguyên tử Na; 0,3 mol phân tử O2
b) 1,2 mol phân tử HNO3; 0,5 mol phân tử Cu
c) 0,125 mol của mỗi chất sau: KNO3, KMnO4, KClO3
Câu 7. Tính số mol của những lượng chất sau:
a) 4,6 gam Na; 8,4 gam KOH; 11,76 gam H3PO4; 16 gam Fe2O3
b) 2,24 lít khí C2H4; 3,36 lít khí CO2, 10,08 lít khí N2. Các thể tích đo ở đktc.
Câu 8. Tính khối lượng (gam) của các lượng chất sau:
a) 6,72 lít khí SO2; 1,344 lít khí Cl2. Các thể tích khí được đo ở đktc.
b) 0,32 mol Na2O; 1,44 mol CaCO3
Câu 9.
a) Phải lấy bao nhiêu gam KOH để có được số phân tử bằng số nguyên tử có trong 4,8 gam Magie?
b) Phải lấy bao nhiêu gam NaCl để có số phân tử bằng số phân tử có trong 3,36 lít khí CO2 (đktc)?
Câu 10. Hỗn hợp X gồm 0,15 mol SO2 và 0,2 mol CO2
a) Tính khối lượng mol trung bình của hỗn hợp X.
b) Tính tỉ khối của hỗn hợp X so với khí NO2
Câu 11. Cho những chất khí sau: CO2, H2, NO2, CH4. Hãy cho biết
a) Những khí nào nặng hay nhẹ hơn không khí và nặng hay nhẹ hơn không khí bao nhiêu lần?
b) Khí CO2 nặng hay nhẹ hơn khí hidro bao nhiêu lần.
Câu 12. Cho hỗn hợp khí X gồm 22 gam khí CO2, 12,8 gam khí SO2 và 15,4 gam khí N2O. Hãy xác định tỉ khối của hỗn hợp X so với khí N2
Câu 13. Xác định tên gọi của chất A, biết ở điều kiện thường A tồn tại ở trạng thái khí có công thức là A2. Tỉ khối của A2 so với khí oxi là 5.
Câu 14. Dẫn khí vào ống nghiệm úp ngược là phương pháp thường dùng để thu một số khí trong phòng thí nghiệm.
a) Những khí như thế nào có thể thu được bằng phương pháp này?
Cho các khí sau: H2, CH4, CO, CO2. Những khí nào có thể thu được bằng phương pháp này?
Câu 15. Phân đạm urê, có công thức hoá học là (NH2)2CO. Phân đạm có vai trò rất quan trọng đối với cây trồng và thực vật nói chung, đặc biệt là cây lấy lá như rau.
a) Khối lượng mol phân tử ure
b) Hãy xác định thành phần phần trăm (theo khối lượng) của các nguyên tố.
Câu 16. Một hợp chất có thành phần các nguyên tố theo khối lượng là: 40% Cu; 20% S và 40%O. Xác định công thức hóa học của chất đó. Biết hợp chất có khối lượng mol là 160g/ mol.
Câu 17. Tính thành phần phần trăm (theo khối lượng) của các nguyên tố hóa học có mặt trong các hợp chất sau:
a) Fe(NO3)2, Fe(NO3)2
b) N2O, NO, NO2
Câu 18. Hãy tìm công thức hóa học của chất X có khối lượng mol MX = 170 (g/mol), thành phần các nguyên tố theo khối lượng: 63,53% Ag; 8,23% N, còn lại O.
Câu 19. Lập công thức hóa học của hợp chất A biết:
Phân khối của hợp chất là 160 đvC
Trong hợp chất có 70% theo khối lượng sắt, còn lại là oxi.
Câu 20. Nhiệt phân hoàn toàn KMnO4 để thu được khí O2 theo sơ đồ phản ứng sau:
KMnO4 -> K2MnO4 + MnO2 + O2
Kết thúc phản ứng thu được 2,24 lít khí Oxi (đktc). Tính khối lượng KMnO4 đã sử dụng.
Câu 21. Cho 6,5 gam Zn tác dụng hết với dung dịch axit HCl thu được muối ZnCl2 và thoát ra V lít khí H2 (đktc).
a) Viết phương trình hóa học xảy ra.
b) Tính thể tích khí H2 (đktc)
Câu 22. Sục 3,36 lít CO2 (đktc) vào dung dịch nước vôi trong Ca(OH)2 thu được Canxi cacbonat và nước.
a) Viết phương trình hóa học xảy ra.
b) Tính khối lượng muối canxi cacbonat thu được sau phản ứng.
Câu 23. Hòa tan 5,3 gam natri cacbonat vào trong dung dịch HCl dư thu được muối natri clorua, khí cacbonic và nước.
a) Viết phương trình hóa học xảy ra.
b) Tính thể tích khí CO2 (đktc) thu được sau phản ứng.
Câu 24. Đốt cháy 5,6 bột sắt trong bình chứa oxi thu được sắt (III) oxit.
a) Viết phương trình hóa học xảy ra.
b) Tính khối lượng sắt (III) oxit sinh ra.
Câu 25. Cho 6,5 gam kẽm tác dụng với 36,5 g dung dịch HCl. Tính khối lượng muối tạo thành sau phản ứng.
Câu 26. Khi cho miếng nhôm tan hết vào dung dịch HCl có chứa 0,2 mol thì sinh ra 1,12 lít khí hidro (đktc).
a. Tính khối lượng miếng nhôm đã phản ứng
b. Axit clohidric còn dư hay không? Nếu còn dư thì khối lượng dư là bao nhiêu?
Câu 27. Cho 6,3 gam hỗn hợp A gồm hai kim loại nhôm và magie tác dụng hết với dung dịch axit clohidric, sau phản ứng thu được 2 muối là nhôm clorua, magie clorua và 6,72 lít khí Hidro (đktc). Tính khối lượng mỗi kim loại trong hỗn hợp A.
Câu 28. Để điều chế các kim loại Cu, Fe người ta tiến hành khử các oxit kim loại ở nhiệt độ cao. Khi khử 20 gam hỗn hợp gồm CuO và Fe2O3 thì cần dùng 7,84 lít khí hidro (đktc).
a. Viết các phương trình hóa học xảy ra
b. Tính thành phần % khối lượng mỗi oxit trong hỗn hợp.
Câu 29. Cho lá kẽm có khối lượng 25 gam vào dung dịch đồng sunfat. Xảy ra phản ứng hoá học sau: Zn + CuSO4 → ZnSO4 + Cu
Sau khi phản ứng kết thúc, đem lá kim loại ra rửa nhẹ, làm khô cân được 24,96 gam.
a. Tính khối lượng kẽm đã phản ứng.
b. Tính khối lượng đồng sunfat có trong dung dịch.
Câu 30. Cho lá sắt có khối lượng 5,6 gam vào dung dịch đồng sunfat.
Fe + CuSO4 → FeSO4 + Cu
Sau một thời gian, nhấc lá sắt ra, rửa nhẹ, làm khô và cân thấy khối lượng lá sắt là 6,4 gam.
a. Tính khối lượng sắt đã phản ứng.
b. Tính khối lượng muối sắt tạo thành sau phản ứng.
II. Hướng dẫn giải bài tập hóa 8 chương 3
Câu 1.
a) 0,6.6.1023 = 3,6.1023 nguyên tử S
b) 1,2.1024 phân tử FeO
c) 6,6.1023 phân tử Cl2
Câu 2.
a) Khối lượng 1 mol nguyên tử Na: 23 gam
b) Khối lượng 0,5 phân tử NaCl: 0,5. (23 + 35,5) = 29,25 gam
c) Khối lượng 0,05 mol phân tử đường glucozo C6H12O6: 0,05. (12.6 + 12 + 16.6) = 9 gam
Câu 3.
a) Thể tích (đktc) của 0,15 mol CO và 0,5 mol H2O là: 0,15.22,4 + 0,5. 22,4 = 14,56 lít
b) Thể tích (đktc) của 0,3 mol SO2 và 0,2 mol N2 là: 0,3.22,4 + 0,2.22,4 = 11,2 lít
c) Thể tích (đktc) của 0,01 mol NO và 1,2 mol N2O5 là: 0,01 .22,4 + 1,2.22,4 = 27,104 lít
Câu 4.
Khối lượng mol phân tử H2O là: MH2O = 1.2 + 16 = 18 g
Khối lượng mol phân tử HCl là: MHCl = 1 + 35,5 = 36,5 g
Khối lượng mol phân tử NaCl là: MNaCl = 23 + 35,5 = 58,5 g
Khối lượng mol phân tử KOH là: MKOH = 39 + 16 + 1 = 56 g
Câu 5.
a) Số mol phân tử HCl bằng: phân tử HCl
({n_{HCl}} = frac{{1,44.1{0^{23}}}}{{{N_A}}} = frac{{1,44.1{0^{23}}}}{{6,02.1{0^{23}}}} = 0,24(mol))
b) Số mol nguyên tử Na bằng: nguyên tử Na
({n_K} = frac{{24.1{0^{23}}}}{{{N_A}}} = frac{{24.1{0^{23}}}}{{6,02.1{0^{23}}}} = 4(mol))
Câu 6.
Áp dụng công thức tính khối lượng: m = n.M (gam)
a) Khối lượng của 0,3 mol nguyên tử Na bằng: mNa = nNa.MNa = 0,3.23 = 6,9 gam
Khối lượng của 0,3 mol phân tử O2 bằng: mO2 = nO2. MO2 = 0,3.32 = 9,6 gam
b) Khối lượng 1,2 mol phân tử HNO3 bằng: mHNO3 = nHNO3.MHNO3 = 1,2 . 63 = 75,6 gam
Khối lượng 0,5 mol phân tử Cu bằng: mCu = nCu.MCu = 0,5.64 = 32 gam
c) Khối lượng 0,125 mol phân tử KNO3 bằng: mKNO3 = nKNO3.MKNO3 = 0,125. 101 = 12,625 gam
Khối lượng 0,125 mol phân tử KMnO4 bằng:
mKMnO4 = nKMnO4.MKMnO4 = 0,125.158 = 19,75 gam
Câu 7.
a) Áp dụng công thức tính số mol: (n = frac{m}{M}left(molright))
Số mol của 4,6 gam Na bằng: (n = frac{m_{Na}}{M_{Na}} = frac{4,6}{23} = 0,2left(molright))
Số mol của 8,4 gam KOH bằng: 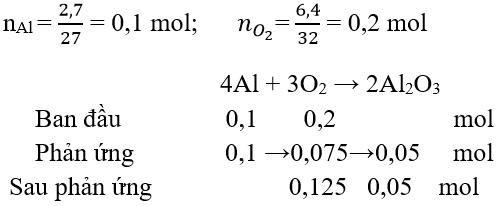 (n = frac{m_{KOH}}{M_{KOH}} = frac{8,4}{56} = 0,15left(molright))
(n = frac{m_{KOH}}{M_{KOH}} = frac{8,4}{56} = 0,15left(molright))
b) Áp dụng công thức tính số mol: (n = frac{V}{22,4}left(molright))
Số mol của 2,24 lít khí C2H4 bằng: (n = frac{V}{22,4} = frac{2,24}{22,4} = 0,1left(molright))
Số mol của 3,36 lít khí CO2 bằng: (n = frac{V}{22,4} = frac{3,36}{22,4} = 0,15left(molright))
Câu 8.
Số mol của khí SO2 bằng: ({n_{S{O_2}}} = frac{V}{{22,4}} = frac{{6,72}}{{22,4}} = 0,3(mol))
Khối lượng của 0,3 mol khí SO2 bằng:
mSO2 = nSO2.MSO2 = 0,3.64 = 19,2 gam
Tương tự làm các phần còn lại
Câu 9.
a) Số mol Magie bằng: ({n_{Mg}} = frac{{{m_{mg}}}}{{{M_{Mg}}}} = frac{{4,8}}{{24}} = 0,2(mol))
Số phân tử KOH bằng số nguyên tửu Mg <=> nKOH = nMg = 0,2 mol
Khối lượng KOH bằng: mKOH = nKOH.MKOH = 0,2 . 56 = 11,2 gam
Câu 10.
a) Khối lượng mol trung bình của hỗn hợp X bằng:
(overline {{M_{hh}}} = frac{{{n_{SO2}}.{M_{SO2}} + {n_{C{O_2}}}.{M_{C{O_2}}}}}{{{n_{S{O_2}}} + {n_{C{O_2}}}}} = frac{{0,15.64 + 0,2.44}}{{0,15 + 0,2}} = 52,57(gam/mol))
b) Tỉ khối của hỗn hợp X so với NO2 bằng:
({d_{X/N{O_2}}} = frac{{overline {{M_X}} }}{{{M_{N{O_2}}}}} = frac{{52,57}}{{46}} approx 1,14)
Câu 11.
Áp dụng công thức:
({d_{A/kk}} = frac{{{M_A}}}{{{M_{kk}}}}.frac{{{M_A}}}{{29}})
- Tỉ khối của khí CO2 so với không khí là:
({d_{C{O_2}/kk}} = frac{{{M_{C{O_2}}}}}{{{M_{kk}}}} = frac{{44}}{{29}} approx 1,52)
Khí CO2 nặng hơn không khí 1,52 lần
- Tỉ khối của khí H2 so với không khí là:
({d_{{H_2}/kk}} = frac{{{M_{{H_2}}}}}{{{M_{kk}}}} = frac{2}{{29}} approx 0,069)
Khí H2 nhẹ hơn không khí 0,069 lần
Tỉ khối của khí NO2 so với không khí là:
({d_{N{O_2}/kk}} = frac{{{M_{N{O_2}}}}}{{{M_{kk}}}} = frac{{46}}{{29}} approx 1,59)
Khí NO2 nặng hơn không khí 1,59 lần
Tỉ khối của khí CH4 so với không khí là:
({d_{C{H_4}/kk}} = frac{{{M_{C{H_4}}}}}{{{M_{kk}}}} = frac{{16}}{{29}} approx 0,55)
Khí CH4 nhẹ hơn không khí 0,55 lần
Câu 12.
Khối lượng mol trung bình của hỗn hợp X:
({n_{C{O_2}}} = frac{{{m_{C{O_2}}}}}{{{M_{C{O_2}}}}} = frac{{22}}{{44}} = 0,5(mol))
({n_{S{O_2}}} = frac{{{m_{S{O_2}}}}}{{{M_{S{O_2}}}}} = frac{{12,8}}{{64}} = 0,2(mol))
({n_{{N_2}O}} = frac{{{m_{{N_2}O}}}}{{{M_{{N_2}O}}}} = frac{{15,4}}{{44}} = 0,35(mol))
Tỉ khối của hỗn hợp X so với khí N2 là:
(overline {{M_X}} = frac{{{m_{S{O_2}}} + {m_{C{O_2}}} + {m_{{N_2}O}}}}{{{n_{S{O_2}}} + {n_{C{O_2}}} + {n_{{N_2}O}}}} = frac{{12,8 + 22 + 15,4}}{{0,2 + 0,5 + 0,35}} = 47,81(gam/mol))
Câu 13.
Tỉ khối A2 so với khí oxi bằng 5
{M_{{A_2}}} = 32.5 = 160 = > 2.A = 160 = > A = 80 end{array}' width='411' height='92'>(begin{array}{l} {d_{{A_2}/{O_2}}} = 5 M {d_{{A_2}/{O_2}}} = frac{{{M_{{A_2}}}}}{{{M_{{O_2}}}}} = frac{{{M_{{A_2}}}}}{{32}} = 5 = > {M_{{A_2}}} = 32.5 = 160 = > 2.A = 160 = > A = 80 end{array})
Vậy A là nguyên tố Brom (Br)
Câu 14.
a) Khi ống nghiệm úp ngược, khí nhẹ hơn không khí sẽ bay lên đáy ống nghiệm, khí nặng hơn không khí sẽ chìm xuống dưới, do đó phương pháp này được sử dụng để thu lấy các khí có khối lượng nhẹ hơn so với không khí.
b) Các khí có thể thu được bằng phương pháp úp ngược ống nghiệm: H2, CH4
Câu 15.
a) Xác định khối lượng mol của hợp chất.
M(NH2)2CO = 14.2+ 2.2 + 12 + 16 = 60 g/mol
Tính thành phần % của mỗi nguyên tố.
(begin{array}{l} % {m_N} = frac{{2.{M_N}}}{{{M_{{{(N{H_2})}_2}CO}}}}.100 = frac{{2.14}}{{60}}.100 = 46,67% % {m_H} = frac{{2.{M_H}}}{{{M_{_{{{(N{H_2})}_2}CO}}}}}.100 = frac{{2.1}}{{60}}.100 = 3,33% % {m_C} = frac{{1{M_C}}}{{{M_{{{(N{H_2})}_2}CO}}}}.100 = frac{{1.12}}{{60}}.100 = 20% % {m_O} = 100% - 46,67% - 3,33% - 20% = 30% end{array})
Câu 16.
(begin{array}{l} {m_{Cu}} = frac{{40.160}}{{100}} = 64gam {m_S} = frac{{20.160}}{{100}} = 32 gam {m_O} = frac{{40.160}}{{100}} = 64 gam end{array})
Số mol nguyên tử của mỗi nguyên tố trong 1 mol hợp chất:
({n_{Cu}} = frac{{64}}{{64}} = {1^{}}mol ; {n_S} = frac{{32}}{{32}} = 1 mol ; {n_O} = frac{{64}}{{16}} = 4 mol)
Trong 1 phân tử hợp chất khí trên có: 1mol nguyên tử Cu; 1 mol nguyên tử S và 4 mol nguyên tử O.
Công thức hóa học của hợp chất trên là CuSO4
Câu 17.
a) Fe(NO3)2 : %mFe = 31,11%; %mN =15,56%; %mO = 53,33%
Fe(NO3)2: %mFe = 23,14%; %mN =17,35%; %mO = 59,51%
b)
N2O: %mN = 63,63%; %mO = 36,37%
NO: %mN = 46,67%; %mO = 53,33%
NO2: %mN = 30,43%; %mO = 69,57%
Câu 18.
Hãy tìm công thức hóa học của chất X có khối lượng mol MX = 170 (g/mol), thành phần các nguyên tố theo khối lượng: 63,53% Ag; 8,23% N, còn lại O.
%mO = 100% - 63,53% - 8,23% = 28,24%
(begin{array}{l} {m_{Ag}} = frac{{63,53.170}}{{100}} = 108gam {m_N} = frac{{8,23.170}}{{100}} = 14 gam {m_O} = frac{{28,24.170}}{{100}} = 48 gam end{array})
Số mol nguyên tử của mỗi nguyên tố trong 1 mol hợp chất:
({n_{Ag}} = frac{{108}}{{108}} = 1 mol ; {n_N} = frac{{14}}{{14}} = 1mol ; {n_O} = frac{{48}}{{16}} = 3 mol)
CTrong 1 phân tử hợp chất khí trên có: 1mol nguyên tử Ag; 1 mol nguyên tử N và 3 mol nguyên tử O.
Công thức hóa học của hợp chất trên là AgNO3
Câu 19.
Khối lượng mol: MA = 160 gam/mol
Khối lượng mỗi nguyên tố có trong 1 mol hợp chất:
({m_{Fe}} = frac{{160.70}}{{100}} = 112gam; {m_O} = frac{{160(100 - 70)}}{{100}} = 48 gam)
Số mol nguyên tử của mỗi nguyên tố trong 1 mol hợp chất:
({n_{Fe}} = frac{{112}}{{56}} = {2^{}}mol ; {n_O} = frac{{48}}{{16}} = 3 mol)
Trong 1 phân tử hợp chất khí trên có: 2 mol nguyên tử Fe; 3 mol nguyên tử O.
Công thức hóa học của hợp chất trên là Fe2O3
Phương trình hóa học của phản ứng nhiệt phân:
2KMnO4 (overset{t^{circ } }{rightarrow}) K2MnO4 + MnO2 + O2
Số mol của Oxi bằng: ({n_{{O_2}}} = frac{{{V_{{O_2}}}}}{{22,4}} = frac{{2,24}}{{22,4}} = 0,1(mol))
Xét phương trình hóa học: 2KMnO4 (overset{t^{circ } }{rightarrow}) K2MnO4 + MnO2 + O2
Theo phương trình hóa học: 2 mol 1 mol
Theo đề bài:(frac{{0,1.2}}{1} = 0,2(mol)) ← 0,1 mol
Từ phương trình hóa học số mol KMnO4 bằng: nKMnO4 = 0,2 mol
Khối lượng của KMnO4 tham gia phản ứng bằng:
mKMnO4 = nKMnO4.MKMnO4 = 0,2.158 = 31,6 (gam)
Câu 21.
Phương trình hóa học của phản ứng:
Zn + 2HCl → ZnCl2 + H2
Số mol của Zn bằng: ({n_{Zn}} = frac{{{m_{Zn}}}}{{{M_{Zn}}}} = frac{{6,5}}{{65}} = 0,1(mol))
Xét phương trình phản ứng: Zn + 2HCl → ZnCl2 + H2
Theo phương trình hóa học: 1 mol 1 mol
Theo đề bài: 0,1 → 0,1 mol
Từ phương trình hóa học số mol H2 bằng: nH2 = 0,1 mol
Thể tích khí H2 sinh ra bằng: VH2 = nH2.22,4 = 0,1.22,4 = 2,24 lít
Câu 22.
Phương trình hóa học của phản ứng:
CO2 + Ca(OH)2 → CaCO3 + H2O
Số mol của CO2 bằng: ({n_{{rm{C}}{{rm{O}}_{rm{2}}}}} = frac{{{V_{{rm{C}}{{rm{O}}_{rm{2}}}}}}}{{22,4}} = frac{{3,36}}{{22,4}} = 0,15(mol))
Xét phương trình phản ứng: CO2 + Ca(OH)2 → CaCO3 + H2O
Theo phương trình hóa học: 1 mol 1 mol
Theo đề bài: 0,15 mol → 0,15 mol
Từ phương trình hóa học số mol CaCO3 bằng 0,15 mol
Khối lượng CaCO3 sau phản ứng bằng: mCaCO3 = nCaCO3.MCaCO3 = 0,15.100 = 15 gam
Câu 23.
Phương trình hóa học của phản ứng:
Na2CO3 + 2HCl → 2NaCl + CO2 + H2O
Số mol của Na2CO3 bằng:
({n_{{rm{N}}{{rm{a}}_{rm{2}}}{rm{C}}{{rm{O}}_{rm{3}}}}} = frac{{{m_{{rm{N}}{{rm{a}}_{rm{2}}}{rm{C}}{{rm{O}}_{rm{3}}}}}}}{{{M_{{rm{N}}{{rm{a}}_{rm{2}}}{rm{C}}{{rm{O}}_{rm{3}}}}}}} = frac{{5,3}}{{106}} = 0,05(mol))
Xét phương trình phản ứng: Na2CO3 + 2HCl → 2NaCl + CO2 + H2O
Theo phương trình hóa học: 1 mol 1 mol
Theo đề bài: 0,05 mol → 0,05 mol
Từ phương trình hóa học số mol CO2 bằng 0,05 mol
Thế tích khí CO2 sinh ra bằng: VCO2 = nCO2.22,4 = 0,05.22,4 = 1,12 lít
Câu 24.
Phương trình hóa học phản ứng
4Fe + 3O2 (overset{t^{o} }{rightarrow}) 2Fe2O3
Tính số mol của sắt:
({n_{Fe}} = frac{{{m_{Fe}}}}{{{M_{Fe}}}} = frac{{14}}{{56}} = 0,25(mol))
Xét phản ứng phản ứng: 4Fe + 3O2 (overset{t^{o} }{rightarrow}) 2Fe2O3
Theo phương trình hóa học: 4mol 2mol
Theo đề bài: 0,25 mol → (frac{{0,25.2}}{4} = 0,125(mol))
Từ phương trình hóa học ta có: nFe2O3 = 0,125 mol
Khối lượng Fe2O3 bằng: mFe2O3 = nFe2O3 . MFe2O3 = 0,125 . 160 = 20 gam
Câu 25.
({n_{Zn}} = frac{{6,5}}{{65}} = 0,1mol); ({n_{HCl}} = frac{{3,65}}{{36,5}} = 0,1mol)
Zn + 2HCl → ZnCl2 + H2Theo phương trình: 1 mol 2 mol 1 mol
Theo đầu bài : 0,1 mol 0,1 mol 0,05 mol
Xét tỉ lệ: frac{{0,1}}{2}' width='92' height='40'>(frac{{0,1}}{1} > frac{{0,1}}{2})→ Zn dư, Khối lượng các chất tính theo lượng HCl
({m_{ZnC{l_2}}} = 0,05 times 136 = 6,8gam)
Câu 26.
Phương trình phản ứng hóa học: 2Al + 6HCl → 2AlCl3 + 3H2
Theo phương trình: 2 mol 6 mol 3 mol
Theo đầu bài: 0,2 mol 0,05 mol
x mol y mol 0,05 mol
(x = {n_{Al}} = frac{{2 times 0,05}}{3}, {m_{Al}} = frac{{0,1}}{3} times 27 = 0,9g)
(y = {n_{HCl}}^{} = frac{{6 times 0,05}}{3} = 0,1mol)
Số mol HCl dư = Số mol HCl ban đầu - Số mol HCl phản ứng = 0,2 - 0,1 = 0,1 mol
=> Khối lượng HCl dư là: 0,1 x 36,5 = 3,65g
Câu 29. Gọi a là số mol của kẽm tham gia phản ứng:
Phương trình hóa học:
Zn + CuSO4 → ZnSO4 + Cu
a mol a mol a mol
Theo đề bài cho độ giảm khối lượng của lá kẽm sau phản ứng là:
mZn tan - mCu bám = 65a - 64a = 25 - 24,96 => a = 0,04 mol
a. Khối lượng kẽm tham gia phản ứng:
m = n x M = 0,04 x 65 = 2,6 gam
b. Khối lượng đồng sunfat là:
m = n x M = 0,04 x 160 = 6,4 gam
Câu 30. Gọi a là số mol của sắt tham gia phản ứng:
Phương trình hóa học:
Fe + CuSO4 → FeSO4 + Cu
a mol a mol a mol
Theo đề bài cho độ tăng khối lượng của lá sắt sau phản ứng là:
m Cu bám - m Zn tan = 64a - 56a = 6,4 - 5,6
a = 0,1 mol
a. Khối lượng sắt tham gia phản ứng:
m = n x M = 0,1 x 5,6 = 5,6 gam
b. Khối lượng muối sắt tạo thành sau phản ứng:
m = n x M = 0,1 x 152 = 15,2 gam
III. Trắc nghiệm Hóa 8 chương 3 Mol và tính toán hóa học
Ngoài các dạng câu hỏi bài tập tự luận, để nâng cao khả năng giải bài tập cũng như cũng cố kĩ năng làm bài, VnDoc biên soạn bộ câu hỏi trắc nghiệm kèm đáp án.Giúp bạn đọc có thêm tài liệu ôn luyện chương 3 tốt nhất. Mời các bạn tham khảo tại:
- Trắc nghiệm chương 3: Mol và tính toán hóa học
Câu 1: 0,5 mol mol nước chứa số nguyên tử
A. 3,01.1023
B. 6,02.1023
C. 3.1023
D. 4.1023
Câu 2: Số mol phân tử Cl2 có trong 7,1 g Cl2
A. 1 mol
B. 0,01 mol
C. 0,1 mol
D. 0,05 mol
Câu 3: Tính %mMg trong 1 mol MgSO4
A. 80%
B. 30%
C. 50%
D. 20%
Câu 4: Số mol tương ứng của 4,8 g C; 8 g O; 0,56 g Fe
A. 0,04 mol, 0,5 mol, 0,1 mol
B. 0,4 mol, 0,5 mol, 0,01 mol
C. 4 mol, 5 mol, 1 mol
D. 0,4 mol, 0,1 mol, 0,3 mol
Câu 5: Kết luận đúng khi nói về khí clo và khí metan
A. MCl2= MCH4
B. Khí clo nặng hơn 4,4375 lần khí metan
C. Khí metan nặng hơn khí clo 2,5 lần
D. Khí metan nặng hơn khí clo 4,4375 lần
Câu 6: Cho 1,6 g S cháy trong không khí thấy có khí có khả năng làm mất màu cánh hoa hồng. Tính thể tích khí đó
A. 1,12 ml
B. 0,102 l
C. 11,2 ml
D. 1,12 l
Câu 7: Cho 2,7 g nhôm tác dụng với 6,4 g O2. Hỏi sau phản ứng thu được những chất nào, biết rằng hóa trị cao nhất của nhôm trong hợp chất là III
A. Al2O3
B. Al
C. O2
D. Al2O3 và O2 dư
Câu 8: Muốn thu khí NO vào bình ta phải
A. Đặt đứng bình
B. Đặt úp bình
C. Cách nào cũng được
D. Lúc đầu để đứng bình rồi chuyển sang để ngang bình.
Câu 9. Tính khối lượng đã phản ứng của HCl khi cho 2,875 g Na tác dụng với nó để sinh ra khí hidro
A. 9,2 g
B. 4,5625 g
C. 12,95 g
D. 1,123 g
Câu 10. Cho dX/H2 = 0,12 nghĩa là gì
A. X nhẹ hơn H2 0,12 lần
B. X nặng hơn H2 0,12 lần
C. Số mol của X và hidro bằng nhau
D. Không kết luận được
Đáp án
1.A2.C3.D4.B5.B6.D7.D8.A9.B10.AHướng dẫn:
Câu 1: số ng.tử = số mol . số Avogadro = 0,5.6,2.1023 = 3,2.1023
Câu 2: n = = 0,1 (mol)
Câu 3:
Câu 4: Sử dụng công thức n = m/M
Câu 5: dCl2/CH4 = 71/16 = 4,4375 ⇒ khí clo nặng hơn khí metan 4,4375 lần
Câu 6: Khí làm mất màu cánh hoa hồng là khí SO2
S + O2 → SO2
0,05 0,05 mol
nS = 1,6/32 = 0,05 mol
VSO2 = 0,05.22,4 = 1,12 l
Câu 7:
nAl = 2,7 : 27 =0,1 mol
nO2 = 6,4: 32 = 0,2 mol
4Al + 3O2 2Al2O3
Vậy sau phản ứng thấy Al2O3 và O2 dư
Câu 8: Xét tỉ khối của NO (M=34) so với không khí(M=29) ta thấy NO nặng hơn không khí nên sẽ chìm xuống dưới. Do vậy, để thu được NO ta phải đặt đứng bình
Câu 9:
nNa=2,875/23=0,125 mol
2Na+2HCl → 2NaCl +H2
0,125→0,125 mol
mHCl = 0,125.36,5 = 4,5625 g
....................
(Để có thể xem chi tiết nội dung tài liệu vui lòng ấn link TẢI VỀ bên dưới)
Trên đây VnDoc đã đưa tới các bạn Bài tập hóa 8 Chương 3: Mol và Tính toán hóa học. Hy vọng thông qua tài liệu trên, các bạn học sinh sẽ nắm vững lý thuyết cũng như vận dụng vào làm bài tập Hóa 8 dễ dàng hơn.
Để có kết quả học tập tốt hơn, VnDoc xin giới thiệu tới các bạn học sinh tài liệu Giải bài tập Hóa học 8; Chuyên đề Hóa học 8; Trắc nghiệm Hóa Học 8 online mà VnDoc tổng hợp biên soạn và đăng tải.
Mời các bạn tham khảo một số tài liệu liên quan:
- Các bài tập về lượng chất dư Hóa học 8
- Các dạng bài tập Hóa 8 đầy đủ từ cơ bản đến nâng cao
- Tính theo phương trình hóa học
- Tóm tắt kiến thức Hóa học 8
- Bài tập Hóa 8 Chương 4: Oxi - Không khí


